2018年1月9日,Nature集团的国际著名期刊自然-通讯《Nature Communications》在线发表了由上海交通大学Bio-X研究院、脑科学与技术研究中心李卫东实验室与中科院生化细胞所陈德桂实验室合作的研究成果“Histone demethylase PHF8 deficiency causes cognitive impairments through the mTOR pathway”。此项研究成果用基因敲除小鼠模型阐明了人类X染色体连锁智力发育障碍候选基因-组蛋白去甲基化酶Phf8缺陷导致认知障碍的机制,并且发现抗癌药物雷帕霉素(Rapamycin)能够治愈出现在小鼠模型中的学习记忆功能缺陷,为智力发育障碍的治疗提供了一种新的可能方案。
智力障碍(Intellectual Disability,ID)是指在18岁之前表现出明显的智力缺陷的一组疾病。研究表明智力障碍患病率为1-3%左右,据估计全世界有超过1亿人遭受该病的影响,再加上社会和家庭的沉重负担,使得智力障碍成为医学中最重要的未解决问题之一。长期以来,X连锁基因缺陷被认为是智力发育迟滞的重要原因(X连锁智力障碍,XLID),如果X染色体上的某些智力发育相关重要基因功能缺失,由于Y染色体缺少X染色体的同源等位基因无法进行功能代偿,因此造成男性患者比女性更常见。在X连锁智力障碍病患家系基因分析中发现了组蛋白去甲基化酶Phf8基因突变,人们开始注意到Phf8基因在大脑认知功能中的潜在重要作用。
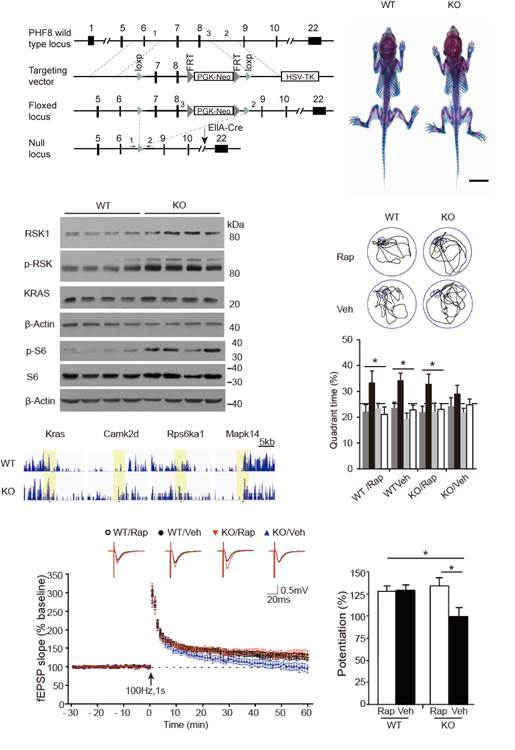
但是Phf8基因突变是如何造成智力障碍的具体机制仍不清楚,李卫东团队与陈德贵团队紧密合作,通过对Phf8基因敲除小鼠的一系列长期研究,终于对这一问题提出了科学的解释。如图所示,研究发现基因敲除小鼠能够模拟病患中广泛出现的学习记忆障碍:在Morris水迷宫和条件恐惧记忆试验中均表现学习和记忆的认知功能障碍。长时程增强(LTP)是学习记忆的细胞水平的神经可塑性基础,实验结果显示Phf8基因敲除显著影响了小鼠的海马神经网络的长时程增强。Phf8基因编码一个组蛋白去甲基化蛋白因而具有基因表达调控功能,通过基因芯片和组蛋白免疫沉淀实验,他们筛选出一批可能的PHF8蛋白作用的靶基因,经过进一步验证显示Phf8基因通过组蛋白H4K20me1去甲基化来抑制RSK1的表达以及下游mTOR分子信号通路的活性。而一旦失去了正常的PHF8功能,会造成mTOR通路活性异常增高,从而导致神经可塑性及认知行为学的障碍,如果对异常小鼠施予mTOR抑制剂(雷帕霉素)的干预治疗,可以明显改善基因敲除小鼠中出现的学习记忆异常。
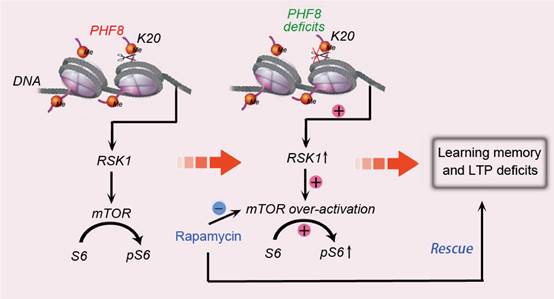
这些发现对X染色体连锁智力障碍的表观遗传学发病机制做出了深入的阐释,并且为未来智力障碍和神经精神疾病的治疗提供了新的靶点与思路。
上海交通大学李卫东研究员和中科院上海生化细胞所陈德桂研究员为该文共同通讯作者,上海交通大学陈雪梅、王帅、周颖、韩燕飞、李胜天为共同第一作者。该研究工作得到了国家重大仪器专项、973计划、自然基金委、中科院先导计划、上海市东方学者跟踪计划、上海市优秀学术带头人等项目的支持。
原文出处:https://www.nature.com/articles/s41467-017-02531-y


